|
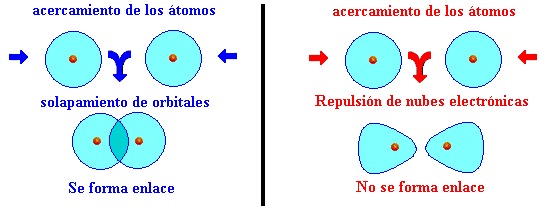
La mecánica cuántica proporciona una explicación más completa del enlace covalente de lo que lo hace la teoría de Lewis de la compartición de electrones, justificando el papel del par de electrones en la constitución de los enlaces y, al mismo tiempo, describiendo la geometría de las moléculas formadas. Consideremos la formación de una molécula de hidrógeno (H2). Cuando los dos átomos de Hidrógeno se aproximan, sus núcleos atraen cada vez más a las nubes electrónicas del otro átomo. Llega un momento en que las nubes se solapan parcialmente, con lo que la densidad electrónica entre los núcleos se ve incrementada. Es esta densidad electrónica elevada la que mantiene unidos, por atracción electrostática los dos núcleos, quedando así constituida la molécula. La formación del enlace H – H, puede expresarse, por tanto, diciendo que se solapan los orbitales 1s de los dos átomos. El solapamiento supone que ambos orbitales comparten una región común del espacio entre los dos núcleos, donde podríamos decir que la probabilidad de encontrar al electrón es máxima.
Desde el punto de vista energético, cuando los átomos están muy
separados, no hay interacción (E=0).
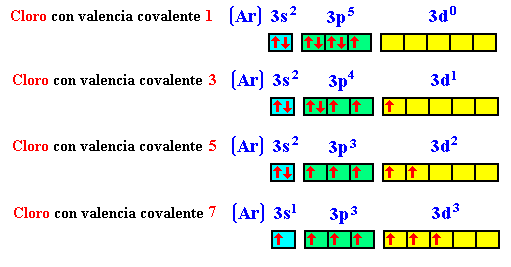
Una idea que conviene subrayar es que, para que el proceso sea favorable, los orbitales atómicos que se solapan espacialmente deben poseer electrones desapareados con espines opuestos (para no incumplir el principio de exclusión de Pauli). Esto también explicaría la razón por la que los gases nobles no se unen ni siquiera consigo mismos, ya que no tienen electrones desapareados. Así pues, la covalencia de un elemento o, el número de enlaces covalentes que podrá formar es igual al número de electrones que posee desapareados. Por ejemplo el flúor tiene una covalencia de 1, el oxígeno de 2. Algunos elementos tienen más de una covalencia ya que al tener orbitales vacíos pueden desaparear electrones, por ejemplo, el cloro tiene una covalencia de 1, 3, 5 ó 7 porque posee los orbitales “3d” vacíos.
En la teoría de los enlaces de valencia (TEV), los orbitales moleculares se forman por solapamiento de los orbitales atómicos. Para un mejor solapamiento de los orbitales atómicos de partida, estos deben tener tamaño y energías parecidas, así como estructuras espaciales adecuadas. La simetría de los orbitales moleculares formados, depende de los orbitales atómicos que participan en el enlace y de la forma en que se solapan. No vamos a profundizar mucho en el tema, pero comentaremos que existen dos posibilidades: a) Orbitales moleculares sigma (σ): Los orbitales atómicos se solapan frontalmente y se produce un único solapamiento de las respectivas nubes electrónicas. Tiene un eje de simetría con respecto a la línea que une los dos núcleos. Una rotación con respecto a dicho eje no produce ningún cambio. La máxima probabilidad de encontrar a los electrones en este tipo de orbitales, se concentra entre los dos núcleos fundamentalmente. A continuación te presentamos algunos ejemplos:
b) Orbitales moleculares pi (π): Los orbitales atómicos se solapan lateralmente y se produce dos o más solapamiento de las respectivas nubes electrónicas. Existe un plano nodal de simetría que incluye a los núcleos y la máxima probabilidad de encontrar a los electrones en el orbital molecular formado no se concentra entre los núcleos:
Un orbital molecular es tanto más estable cuanto mayor es el grado de solapamiento entre los orbitales atómicos que lo forman. Los orbitales moleculares s son más estables que los P porque el grado de solapamiento de los orbitales "s" es mayor que el de los "p".
|
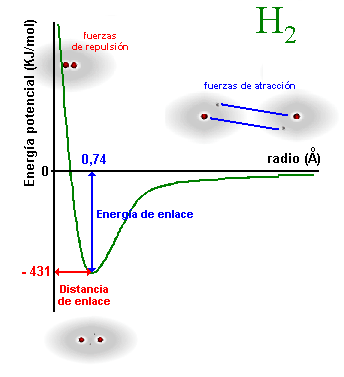 Al
aproximarse, comienza el solapamiento de los orbitales 1s y la fuerza
de atracción entre los átomos se incrementa, con lo que la energía
potencial del sistema disminuye y llega a alcanzar un mínimo. En este
momento, el solapamiento es el óptimo y la distancia entre los núcleos
es precisamente la longitud del enlace H – H de la molécula H2.
Si a partir de este momento, seguimos acercando los átomos, la energía
potencial aumenta debido a la repulsión ejercida por los dos núcleos
de los dos átomos.
Al
aproximarse, comienza el solapamiento de los orbitales 1s y la fuerza
de atracción entre los átomos se incrementa, con lo que la energía
potencial del sistema disminuye y llega a alcanzar un mínimo. En este
momento, el solapamiento es el óptimo y la distancia entre los núcleos
es precisamente la longitud del enlace H – H de la molécula H2.
Si a partir de este momento, seguimos acercando los átomos, la energía
potencial aumenta debido a la repulsión ejercida por los dos núcleos
de los dos átomos.